上游开放阅读框uORF广泛存在于动植物基因的5’非翻译区,通常能够抑制下游主开放阅读框pORF的翻译。高彩霞研究组率先利用CRISPR/Cas9技术对uORF进行编辑,发现能够显著提高目标基因的翻译效率,建立了利用基因组编辑调控内源基因蛋白质翻译效率的新方法,相关成果于2018年发表在Nature Biotechnology;该方法可以培育出不含转基因成分的基因过表达植物,为作物育种及功能基因研究提供了十分重要的技术手段。由于uORF在动植物基因组中普遍存在,编辑uORF提高内源蛋白水平将有广泛的应用。为了进一步普及和促进该方法的使用,中国科学院遗传与发育生物学研究所高彩霞研究组日前在Nature Protocols发表文章,详细介绍对植物基因的uORF进行编辑提高目标基因翻译效率的具体实验流程。
真核细胞的mRNA由5’非翻译区(5’ Untranslated Region, 5’UTR)、编码蛋白的开放阅读框区(Open Reading Frame)及3’端非翻译区(3’ Untranslated Region, 3’UTR)构成。上游开放阅读框(uORF, Upstream Open Reading Frame)是位于cDNA 5’前导序列(5’ Leader Sequence)的一类元件,在动植物中广泛存在,可以参与基因翻译水平的调控, 在很多情况下对基因主开放阅读框(pORF, Primary Open Reading Frame)的翻译具有抑制作用。本技术论文在此基础上详细介绍了如何利用基因组编辑技术修饰基因的uORF,实现调控目的基因的表达。整个流程包括:植物内源基因uORF的预测;双荧光素酶报告系统验证;预测的uORF对目的基因翻译水平的影响;设计并构建sgRNA对uORF进行编辑;瞬时实验中验证基因组编辑技术突变的uorfs序列对下游目的基因表达的影响;筛选transgene-free的纯合uorf突变体植株并分析脱靶效应;在mRNA、蛋白和表型水平对野生型、uorf突变体植株中的目的基因表达量测定等具体方法和实验细节。其中预测并在瞬时实验中确定uORF的功能需要2-3周时间。4个月左右可以获得目的基因表达水平不同程度增强的uorf突变体。
该文章于2020年1月8日在线发表于Nature Protocols杂志上(DOI:10.1038/s41596-019-0238-3)。高彩霞研究组博士生司小敏为该论文的第一作者,高彩霞研究员为通讯作者。相关研究得到科技部、国家自然科学基金委等的资助。
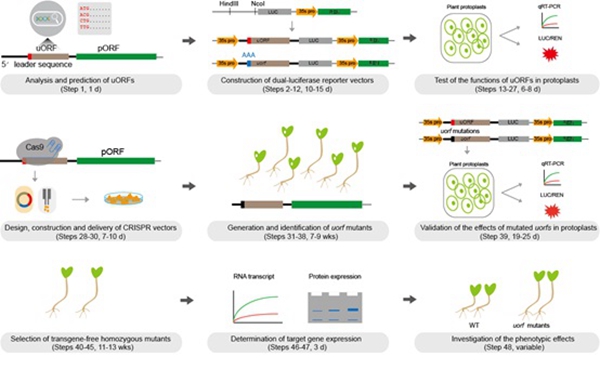
图:利用基因组编辑技术修饰植物基因uORF,调控目的基因翻译水平。