植物叶绿体内的蛋白质大部分直接或间接参与光合作用,而蛋白质稳态主要由两类蛋白质调控:一类是负责蛋白质折叠的分子伴侣,另一类是负责蛋白质降解的蛋白酶体。植物细胞与染色体工程国家重点实验室刘翠敏研究组发现叶绿体辅分子伴侣素Cpn20与分子伴侣Cpn60相互作用协助蛋白质折叠,同时Cpn20与ClpP相互作用减慢ClpP降解底物的速度。 研究者通过亲合标签从莱茵衣藻(Chlamydomonas reinhardtii)叶绿体内纯化了完整的ClpP蛋白酶复合体。质谱和免疫印迹的结果表明蛋白产物中含有一定量的辅分子伴侣素Cpn11/20/23。体外生化实验证明了辅分子伴侣素Cpn11/20/23与衣藻叶绿体ClpP蛋白酶复合体相互作用,并且抑制ClpP蛋白酶的降解底物活力。利用单颗粒冷冻电镜技术获得了ClpP与ClpP-Cpn11/20/23复合体近原子水平的高分辨蛋白结构。衣藻叶绿体ClpP蛋白酶由众多亚基组成(图1),外形呈现出一个非对称的“茶壶”结构,通过中心区域的高分辨率,进一步明确各个亚基的位置与排布。Cpn11/20/23的结合在ClpP蛋白酶的底物运输通道,所以抑制了蛋白酶的活性。而且Cpn11/20/23利用相同的环结构与Cpn60与ClpP相互作用,表明其在叶绿体内重要的调控作用(图2)。该研究结果首次阐明了真核细胞叶绿体中ClpP复合体的三维结构和催化机理,同时也发现了辅分子伴侣素Cpn11/20/23的全新生化功能。为深入理解分子伴侣素与蛋白酶相互配合共同调节质体内蛋白质稳态,提供了崭新的科学视角。
该论文与2021年11月15日在线发表于Nature Plants杂志上(DOI:10.1038/s41477-021-01020-x)。刘翠敏研究组博士生王宁与上海生化所丛尧研究组博士生汪一帆为该论文的共同第一作者,刘翠敏研究员和上海生化所丛尧研究员为该论文的共同通讯作者。该研究得到了中科院先导项目(Grant No. XDA24020103-2, XDB37040103),国家重点研发计划(2016YFD0100405, 2017YFA0503503),法国the ‘Initiative d'Excellence’ program from the French State (Grant ‘DYNAMO’, ANR-11-LABX-0011-01),德国DFG基金(TRR 175, project C02)的资助。
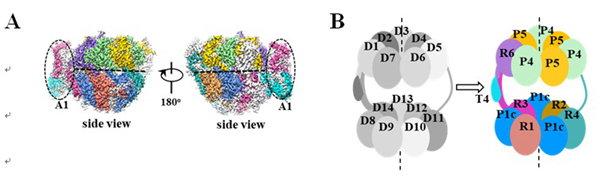
图1: 莱茵衣藻叶绿体ClpP蛋白酶复合体的三维结构与亚基排列。
(A)莱茵衣藻叶绿体ClpP蛋白酶复合体的冷冻电镜结构。一个颜色代表一种亚基。灰色的电子密度区域是未鉴定的部分。(B)ClpP蛋白酶复合体中各亚基排布示意图。
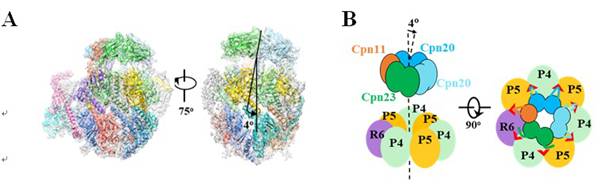
图2: 辅分子伴侣素与ClpP蛋白酶复合体的三维结构与亚基排列。
(A)莱茵衣藻叶绿体ClpP-Cpn23/20/11复合体的冷冻电镜结构。顶部的帽子结构是辅分子伴侣素。(B)辅分子伴侣素与ClpP上环相互作用的亚基排布示意图。