基因组编辑可以对生物体遗传信息进行精准、高效的修饰,已经成为生命科学领域的一项颠覆性技术。通过融合nCas9 (切口酶形式的Cas9) 与脱氨酶,哈佛大学David Liu团队先后开发出了具有里程碑意义的胞嘧啶碱基编辑系统 (Cytosine base editor, CBE) 及腺嘌呤碱基编辑系统 (Adenine base editor, ABE),将以CRISPR为代表的基因组编辑技术引入了“精准编辑”的全新时代。 最近,植物细胞与染色体工程国家重点实验室高彩霞团队开发了一种突破CRISPR限制的模块化结构的碱基编辑新系统—CyDENT。与此前的碱基编辑工具不同的是,这一系统在细胞核、线粒体和叶绿体中均实现了高效胞嘧啶碱基编辑,尤其是在线粒体编辑中展现出了优良的链特异性和低序列偏好性,提供了一种具有广泛基因组靶向能力且高精准的全新碱基编辑工具。
CyDENT系统包含TALE蛋白、FokI切口酶、单链特异性胞嘧啶脱氨酶、DNA外切酶及UGI等组分,并基于一套全新的工作模型:首先由TALE蛋白引导FokI切口酶至细胞核或者细胞器的DNA靶点处产生单链切口,之后由DNA外切酶从切口处对包含切口的DNA链进行部分外切消化,此时互补链将以单链DNA的形式呈现,成为单链特异性胞嘧啶脱氨酶的作用底物,并在UGI的帮助下最终完成胞嘧啶碱基编辑。由于能够发生脱氨的DNA链取决于切口产生的位置,该工作模型能够实现具有单链偏好性的碱基编辑,大大提高了编辑精准度。
研究人员分别选取了水稻原生质体细胞核、叶绿体以及HEK293T细胞系线粒体中的靶点进行了测试。结果显示,CyDENT均可以实现高效的胞嘧啶碱基编辑,其中在动物细胞线粒体中的编辑效率接近40%;更为重要的是,CyDENT系统可以进行具有单链偏好性的线粒体碱基编辑,精准性相较于基于双链脱氨原理的线粒体碱基编辑器得到了大幅提升。此外,得益于CyDENT系统的模块化特性,研究人员还将该团队近期利用AI辅助挖掘得到的全新脱氨酶(DOI: 10.1016/j.cell.2023.05.041)与其进行结合,成功对处于不同序列背景 (TC或GC) 下的胞嘧啶进行了有效编辑,提升了碱基编辑的精准性和灵活性。通过将胞嘧啶脱氨酶更换为腺嘌呤脱氨酶,CyDENT还具有进行腺嘌呤碱基编辑的潜力。最后,通过全核基因组和全线粒体基因组脱靶分析表明了CyDENT具有良好的编辑特异性。
总的来说,具有完全自主知识产权的不依赖CRISPR的全新碱基编辑工具CyDENT首次集成了对细胞核和细胞器进行精准碱基编辑的能力。结合该团队前期挖掘的全新脱氨酶,进一步实现了CyDENT系统从核心组分到底层工作模型的全自主创新。CyDENT系统的开发再次升级了细胞核及细胞器的精准编辑策略,对于疾病治疗和农作物精准分子育种具有重要的潜在应用价值。
研究结果以题为“Strand-preferred base editing of organellar and nuclear genomes using CyDENT”的研究论文于2023年8月28日在线发表于《Nature Biotechnology》 (DOI : 10.1038/s41587-023-01910-9)。该研究得到了农业农村部、中国科学院战略性先导专项、国家重点研发计划项目、国家自然科学基金等项目的资助。中国科学院遗传与发育生物学研究所高彩霞研究组博士后胡佳成,硕士生孙瑜,博士生李帛树为该论文的并列第一作者;高彩霞研究员与齐禾生科生物科技有限公司的Kevin Tianmeng Zhao博士为本文共同通讯作者。
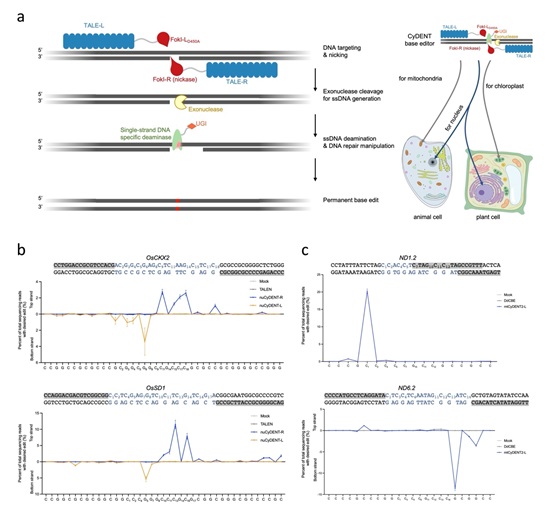
图: CyDENT碱基编辑系统及其应用。(a) CyDENT碱基编辑工作模型及在细胞核和细胞器编辑中的应用;
(b) CyDENT在植物细胞核中的单链特异性碱基编辑;(c) CyDENT在动物细胞线粒体中的单链特异性碱基编辑。